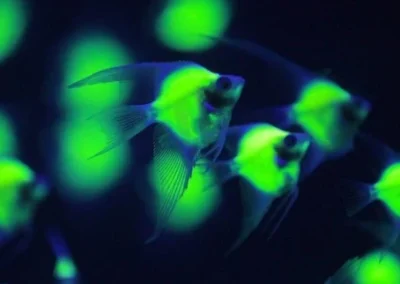
Acquario
Fluorescenza, glofish..
..e modifica gentetica nei pesci d’acquario
Interventi sul DNA
La possibilità di riscrivere il genoma di un organismo, o anche di un’intera specie, è stata a lungo oggetto di fantascienza. Ma con lo sviluppo di CRISPR (che sta per “clustered regularly interspaced short palindromic repeats” cioè “ragruppamento regolarmente interspaziato a brevi ripetizioni palindromiche”), un metodo per modificare il DNA molto più preciso ed efficiente di quanto fosse possibile con le vecchie tecnologie, la finzione si è avvicinata alla realtà. CRISPR sfrutta un antico sistema che permette ai batteri di acquisire l’immunità dai virus. Utilizza un enzima chiamato Cas9 per tagliare i filamenti di DNA in punti precisamente mirati, consentendo ai ricercatori di inserire nuovo materiale genetico.

Cos’è la “fluorescenza”
La fluorescenza è l’emissione di luce da parte di una sostanza che ha assorbito luce o altra radiazione elettromagnetica. È una forma di luminescenza. Nella maggior parte dei casi, la luce emessa ha una lunghezza d’onda maggiore, e quindi un’energia fotonica inferiore, rispetto alla radiazione assorbita. Un esempio percettibile di fluorescenza si ha quando la radiazione assorbita è nella regione dell’ultravioletto dello spettro elettromagnetico (invisibile all’occhio umano), mentre la luce emessa è nella regione del visibile; questo conferisce alla sostanza fluorescente un colore distinto che può essere visto solo quando la sostanza è stata esposta alla luce UV. I materiali fluorescenti cessano di brillare quasi immediatamente quando la sorgente di radiazione si ferma, a differenza dei materiali fosforescenti, che continuano a emettere luce per qualche tempo dopo.
La fluorescenza ha molte applicazioni pratiche, tra cui mineralogia, gemmologia, medicina, sensori chimici (spettroscopia di fluorescenza), etichettatura fluorescente, coloranti, rivelatori biologici, rilevamento di raggi cosmici, display fluorescenti sottovuoto e tubi a raggi catodici. La sua applicazione quotidiana più comune è nelle lampade fluorescenti (a scarica di gas) e nelle lampade a LED, in cui i rivestimenti fluorescenti convertono la luce UV o blu in lunghezze d’onda più lunghe risultando in una luce bianca che può anche apparire indistinguibile da quella delle tradizionali lampade a incandescenza ma a basso consumo energetico lampada.
La fluorescenza si verifica frequentemente in natura in alcuni minerali e in molte forme biologiche in tutti i regni della vita. Quest’ultimo può essere indicato come biofluorescenza, indicando che il fluoroforo fa parte o è estratto da un organismo vivente (piuttosto che da un colorante o colorante inorganico). Ma poiché la fluorescenza è dovuta a una specifica sostanza chimica, che nella maggior parte dei casi può anche essere sintetizzata artificialmente, è sufficiente descrivere la sostanza stessa come fluorescente.
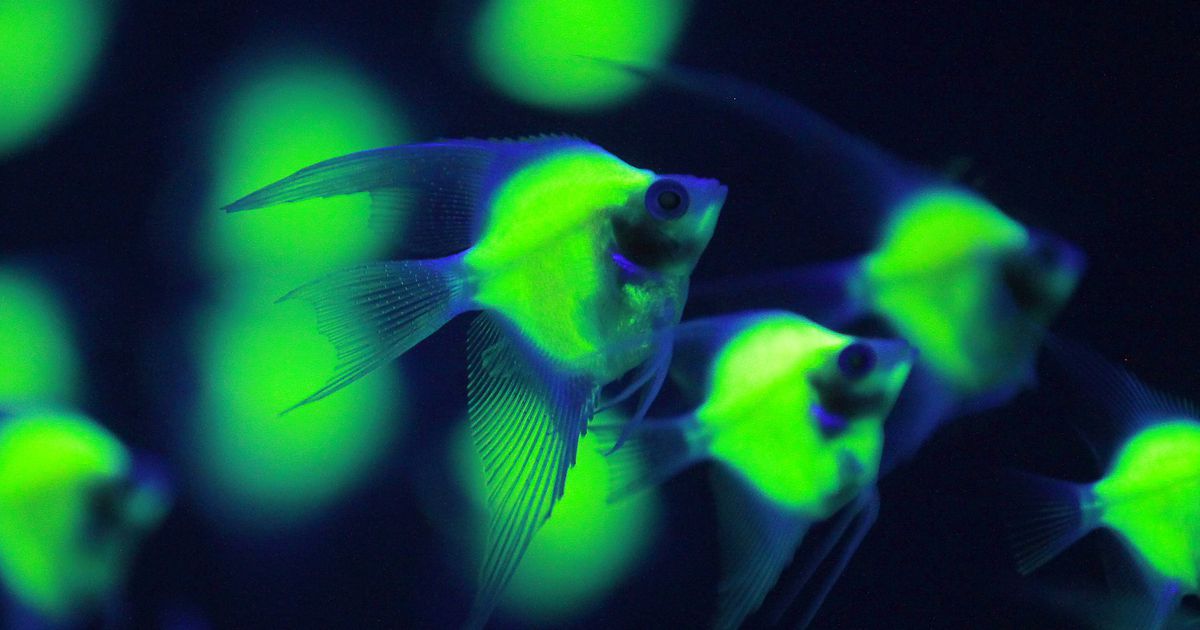
Pterophyllum scalare geneticamente modificati,
“brillano” in una vasca sotto una luce violacea al 2013 Bio Expo in TaipeiPicture. Pichi Chuang/Reuters
Cos’è il CRISPR, storia
L’interesse per un potente strumento di modifica del DNA chiamato CRISPR ha rivelato che i batteri sono molto più sofisticati di quanto si potesse immaginare.
Una sera di novembre dell’anno scorso, Jennifer Doudna ha indossato un elegante abito da sera nero e si è diretta all’Hangar One, un edificio dell’Ames Research Center della NASA che è stato costruito nel 1932 per ospitare i dirigibili. Sotto gli archi incombenti dell’hangar, Doudna si è mescolata a celebrità come Benedict Cumberbatch, Cameron Diaz e Jon Hamm prima di ricevere il Breakthrough Prize 2015 nelle scienze della vita, un premio sponsorizzato da Mark Zuckerberg e altri miliardari della tecnologia. Doudna, biochimica dell’Università della California, Berkeley, e la sua collaboratrice, Emmanuelle Charpentier dell’Helmholtz Center for Infection Research in Germania, hanno ricevuto ciascuno 3 milioni di dollari per la loro invenzione di uno strumento potenzialmente rivoluzionario per l’editing del DNA noto come CRISPR.
Doudna non era un’emerita dai capelli grigi celebrata per il lavoro che faceva quando i dirigibili governavano il cielo. Solo nel 2012 Doudna, Charpentier e i loro colleghi hanno offerto la prima dimostrazione del potenziale di CRISPR. Hanno creato molecole che potrebbero entrare in un microbo e tagliarne con precisione il DNA in una posizione scelta dai ricercatori. Nel gennaio 2013, gli scienziati hanno fatto un ulteriore passo avanti: hanno ritagliato un particolare pezzo di DNA nelle cellule umane e lo hanno sostituito con un altro.
Nello stesso mese, team separati di scienziati dell’Università di Harvard e del Broad Institute hanno riportato un successo simile con lo strumento di modifica genetica. È iniziata una fuga precipitosa scientifica e negli ultimi due anni i ricercatori hanno eseguito centinaia di esperimenti su CRISPR. I loro risultati suggeriscono che la tecnica può cambiare radicalmente sia la medicina che l’agricoltura.
Alcuni scienziati hanno riparato il DNA difettoso nei topi, ad esempio, curandoli da malattie genetiche. Gli scienziati delle piante hanno utilizzato CRISPR per modificare i geni nelle colture, aumentando la speranza che possano progettare una migliore fornitura di cibo. Alcuni ricercatori stanno cercando di riscrivere i genomi degli elefanti, con l’obiettivo finale di ricreare un mammut lanoso. Scrivendo l’anno scorso sulla rivista Reproductive Biology and Endocrinology, Motoko Araki e Tetsuya Ishii dell’Università di Hokkaido in Giappone hanno predetto che i medici saranno in grado di utilizzare il CRISPR per alterare i geni degli embrioni umani “nell’immediato futuro”.
Grazie alla velocità della ricerca CRISPR, i riconoscimenti sono arrivati rapidamente. L’anno scorso il MIT Technology Review ha definito CRISPR “la più grande scoperta biotecnologica del secolo”. Il Breakthrough Prize è solo uno dei numerosi premi importanti che Doudna ha vinto negli ultimi mesi per il suo lavoro su CRISPR; La National Public Radio ha recentemente riportato sussurri di un possibile Nobel nel suo futuro.
Anche l’industria farmaceutica, che spesso è lenta nell’abbracciare i nuovi progressi scientifici, si sta affrettando a entrare in azione. Nuove aziende che sviluppano la medicina basata su CRISPR stanno aprendo le loro porte. A gennaio, il colosso farmaceutico Novartis ha annunciato che avrebbe utilizzato la tecnologia CRISPR di Doudna per la sua ricerca sui trattamenti contro il cancro. Ha in programma di modificare i geni delle cellule immunitarie in modo che attaccheranno i tumori.
Ma in mezzo a tutte le serate di gala e alle richieste di brevetto, è facile trascurare il fatto più importante del CRISPR: nessuno l’ha davvero inventato.
Doudna e altri ricercatori non hanno strappato le molecole che usano per l’editing genetico dal nulla. In effetti, si sono imbattuti nelle molecole CRISPR in natura. I microbi li usano per modificare il proprio DNA da milioni di anni e oggi continuano a farlo in tutto il pianeta, dal fondo del mare ai recessi del nostro stesso corpo.
Abbiamo appena iniziato a capire come funziona CRISPR nel mondo naturale. I microbi lo usano come un sofisticato sistema immunitario, permettendo loro di imparare a riconoscere i loro nemici. Ora gli scienziati stanno scoprendo che i microbi usano CRISPR anche per altri lavori. La storia naturale del CRISPR pone molte domande agli scienziati, per le quali non hanno ancora ottime risposte. Ma mantiene anche una grande promessa. Doudna e i suoi colleghi hanno sfruttato un tipo di CRISPR, ma gli scienziati stanno trovando un vasto serraglio di diversi tipi. Sfruttare questa diversità potrebbe portare a una tecnologia di editing genetico più efficace o aprire la strada ad applicazioni a cui nessuno ha ancora pensato.
“Puoi immaginare che molti laboratori, incluso il nostro, stiano studiando alacremente altre varianti e come funzionano”, ha detto Doudna. “Quindi restate sintonizzati.”

Jennifer Anne Doudna
Un mistero ripetuto
Gli scienziati che hanno scoperto CRISPR non avevano modo di sapere di aver scoperto qualcosa di così rivoluzionario. Non capivano nemmeno cosa avevano trovato. Nel 1987, Yoshizumi Ishino e colleghi dell’Università di Osaka in Giappone hanno pubblicato la sequenza di un gene chiamato iap appartenente al microbo intestinale E. coli. Per capire meglio come funzionava il gene, gli scienziati hanno anche sequenziato parte del DNA che lo circonda. Speravano di trovare punti in cui le proteine atterravano, accendendo e spegnendo iap. Ma invece di un interruttore, gli scienziati hanno trovato qualcosa di incomprensibile.
Vicino al gene iap giacciono cinque segmenti identici di DNA. Il DNA è costituito da elementi costitutivi chiamati basi e i cinque segmenti erano composti ciascuno dalle stesse 29 basi. Queste sequenze ripetute sono state separate l’una dall’altra da blocchi di DNA di 32 basi, chiamati distanziatori. A differenza delle sequenze ripetute, ciascuno dei distanziatori aveva una sequenza unica. Questo peculiare sandwich genetico non assomigliava a nulla che i biologi avessero trovato prima. Quando i ricercatori giapponesi hanno pubblicato i loro risultati, hanno potuto solo alzare le spalle. “Il significato biologico di queste sequenze non è noto”, hanno scritto. All’epoca era difficile sapere se le sequenze fossero esclusive di E. coli, perché i microbiologi avevano solo tecniche grezze per decifrare il DNA. Ma negli anni ’90, i progressi tecnologici hanno permesso loro di accelerare il loro sequenziamento. Entro la fine del decennio, i microbiologi potrebbero raccogliere l’acqua di mare o il suolo e sequenziare rapidamente gran parte del DNA nel campione. Questa tecnica, chiamata metagenomica, ha rivelato quegli strani sandwich genetici in un numero impressionante di specie di microbi. Sono diventati così comuni che gli scienziati avevano bisogno di un nome per parlarne, anche se non sapevano ancora a cosa servissero le sequenze. Nel 2002, Ruud Jansen dell’Università di Utrecht nei Paesi Bassi e colleghi hanno soprannominato questi panini “brevi ripetizioni palindromiche a grappolo regolarmente interspaziate” – CRISPR in breve. Il team di Jansen ha notato qualcos’altro sulle sequenze CRISPR: erano sempre accompagnate da una raccolta di geni nelle vicinanze. Hanno chiamato questi geni geni Cas, per i geni associati a CRISPR. I geni codificavano enzimi che potevano tagliare il DNA, ma nessuno poteva dire perché lo facessero, o perché si sedessero sempre accanto alla sequenza CRISPR. Tre anni dopo, tre team di scienziati hanno notato indipendentemente qualcosa di strano sui distanziatori CRISPR. Assomigliavano molto al DNA dei virus. “E poi tutto è scattato”, ha detto Eugene Koonin. A quel tempo, Koonin, un biologo evoluzionista presso il National Center for Biotechnology Information di Bethesda, Maryland, si era interrogato sui geni CRISPR e Cas per alcuni anni. Non appena ha appreso della scoperta di frammenti di DNA virale nei distanziatori CRISPR, si è reso conto che i microbi stavano usando CRISPR come arma contro i virus. Koonin sapeva che i microbi non sono vittime passive di attacchi di virus. Hanno diverse linee di difesa. Koonin pensava che gli enzimi CRISPR e Cas ne fornissero uno in più. Nell’ipotesi di Koonin, i batteri usano gli enzimi Cas per afferrare frammenti di DNA virale. Quindi inseriscono i frammenti del virus nelle proprie sequenze CRISPR. Successivamente, quando si presenta un altro virus, i batteri possono utilizzare la sequenza CRISPR come un cheat sheet per riconoscere l’invasore. Gli scienziati non sapevano abbastanza sulla funzione degli enzimi CRISPR e Cas perché Koonin potesse formulare un’ipotesi dettagliata. Ma il suo pensiero era abbastanza provocatorio da consentire a un microbiologo di nome Rodolphe Barrangou di testarlo. Per Barrangou, l’idea di Koonin non era solo affascinante, ma potenzialmente un grosso affare per il suo datore di lavoro dell’epoca, il produttore di yogurt Danisco. Danisco dipendeva dai batteri per convertire il latte in yogurt e talvolta intere colture sarebbero andate perse a causa di focolai di virus che uccidono i batteri. Ora Koonin stava suggerendo che i batteri potrebbero usare CRISPR come arma contro questi nemici. Per testare l’ipotesi di Koonin, Barrangou e i suoi colleghi hanno infettato il microbo che fermenta il latte Streptococcus thermophilus con due ceppi di virus. I virus hanno ucciso molti dei batteri, ma alcuni sono sopravvissuti. Quando quei batteri resistenti si sono moltiplicati, anche i loro discendenti si sono rivelati resistenti. Si era verificato un cambiamento genetico. Barrangou e i suoi colleghi hanno scoperto che i batteri avevano riempito i frammenti di DNA dei due virus nei loro distanziatori. Quando gli scienziati hanno eliminato i nuovi distanziatori, i batteri hanno perso la loro resistenza. Barrangou, ora professore associato presso la North Carolina State University, ha affermato che questa scoperta ha portato molti produttori a selezionare sequenze CRISPR personalizzate nelle loro colture, in modo che i batteri potessero resistere alle epidemie di virus. “Se hai mangiato yogurt o formaggio, è probabile che tu abbia mangiato cellule CRISPR-ized”, ha detto.
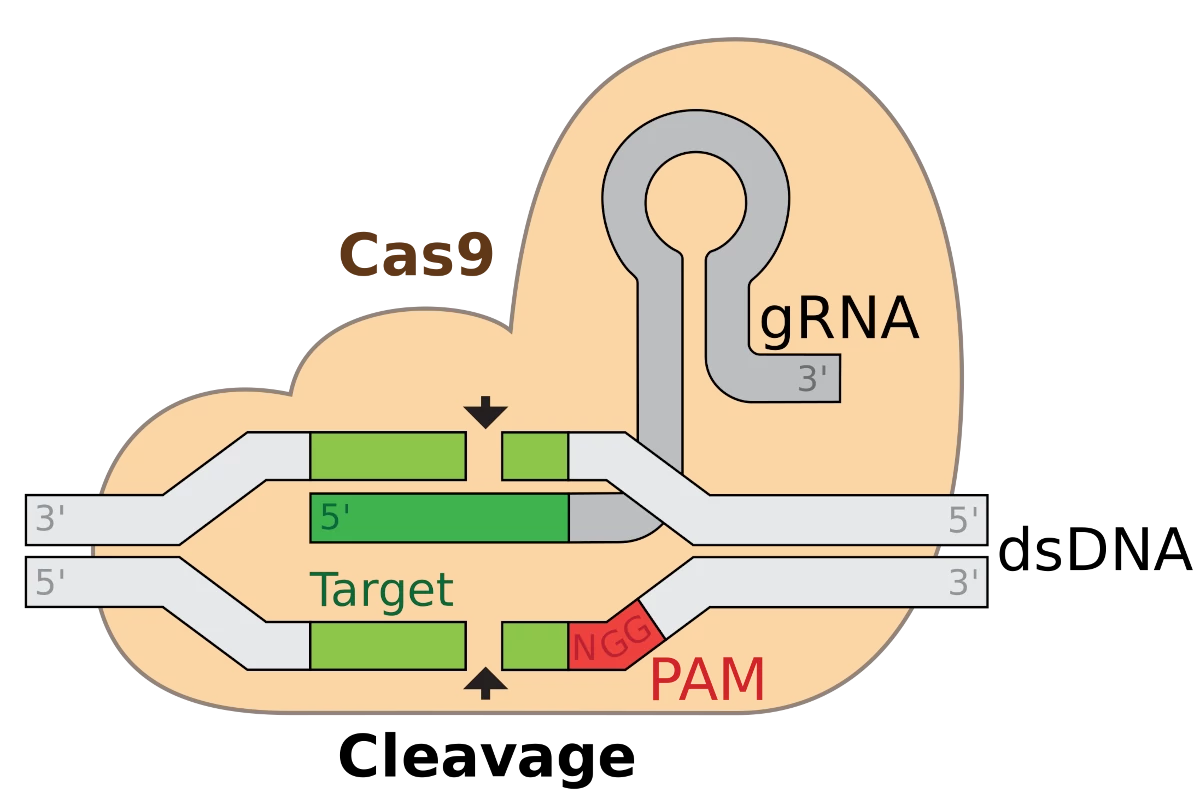
Taglia e incolla
Quando CRISPR ha iniziato a svelare i suoi segreti, Doudna si è incuriosita. Si era già fatta un nome come esperta di RNA, cugina a filamento singolo del DNA. In origine, gli scienziati avevano visto il lavoro principale dell’RNA come messaggero. Le cellule farebbero una copia di un gene usando l’RNA e quindi userebbero quell’RNA messaggero come modello per costruire una proteina. Ma Doudna e altri scienziati hanno illuminato molti altri lavori che l’RNA può svolgere, come agire come sensori o controllare l’attività dei geni.
Nel 2007, Blake Wiedenheft è entrato a far parte del laboratorio di Doudna come ricercatore post-dottorato, desideroso di studiare la struttura degli enzimi Cas per capire come funzionassero. Doudna ha accettato il piano, non perché pensava che CRISPR avesse un valore pratico, ma solo perché pensava che la chimica potesse essere interessante. “Non stai cercando di raggiungere un obiettivo particolare, tranne la comprensione”, ha detto.
Quando Wiedenheft, Doudna e i loro colleghi hanno capito la struttura degli enzimi Cas, hanno iniziato a vedere come le molecole lavoravano insieme come un sistema. Quando un virus invade un microbo, la cellula ospite afferra un po’ del materiale genetico del virus, ne apre il DNA e inserisce il pezzo di DNA del virus in un distanziatore.
Quando la regione CRISPR si riempie di DNA virale, diventa una galleria molecolare più ricercata, che rappresenta i nemici che il microbo ha incontrato. Il microbo può quindi utilizzare questo DNA virale per trasformare gli enzimi Cas in armi a guida di precisione. Il microbo copia il materiale genetico in ogni distanziatore in una molecola di RNA. Gli enzimi Cas assorbono quindi una delle molecole di RNA e la cullano. Insieme, l’RNA virale e gli enzimi Cas si spostano attraverso la cellula. Se incontrano materiale genetico di un virus che corrisponde all’RNA CRISPR, l’RNA si aggancia saldamente. Gli enzimi Cas tagliano quindi il DNA in due, impedendo al virus di replicarsi.
Pesci d’acquario geneticamente modificati
Ormai sono tantissimi i pesci d’acquario geneticamente modificati, negli Stati Uniti come anche in Asia alcune specie di pesci e i loro fenotipi fluorescenti sono stati brevettati a livello internazionale. Il mercato sta spingendo sempre di più ad abbattere le barriere commerciali che possono vietare gli animali geneticamentente modificati. L’indotto è veramente alto, conseguantemente ci potrebbero essere pochi limiti alla commercializzazione anche in quegli stati dove al momento ci sono più resistenze e meno consensi. Qui sotto una serie di foto di specie d’acquario di pesci geneticamente modificati.
Danio zebrato, una specie molto prolifica che ben si adatta a interventi di modifica genetica

Danio zebrato, fenotipo verde evidenziatore, la razza fluorescente più richiesta ed impressionante
Geticamente modificati: piccolo elenco
Tantissimi pesci d’acquario sono facilmente riproducibili, questo ne consente una diffusione commerciale su larga scala come polli da batteria. Inizialmente erano pochi quelli che venivano modificati geneticamente solo a scopo di studio, al momento invece si può dire che la maggior parte delle specie di pesci usate per il mercato acquariofilo ha il suo omologo transgenico, vediamo alcune delle specie lanciate sul mercato, o che si sta provando ad introdurre per “tastare” l’opinione e la richiesta di mercato:
-
-
- Amatitlania nigrofasciatus
- Pterophyllum scalare
- Corydoras
- Danio
- Puntinus (Barbus)
- Betta
- Pristella tetra
- Epalzeorhynchos frenatum (Labeo)
- Gymnocorymbus ternetzi
- Medaka
- Tanichthys albonubes
- Gold fish
- …………
-
Tra l’altro la produzione in laboratorio in ambiente controllato permette di produrre pesci identici, privi di malattie e con crescita controllata, riusciendo a soddisfare le richieste di mercato in maniera estremamente elastica e ad ottimi prezzi.

Medaka, fenotipi omg

Genetically engineered fish (Archocentrus nigrofasciatus var.) glow in a tank during a news conference before the 2012 Taiwan International Aquarium Expo in Taipei. The fish, which are the world’s first pink fluorescent fish and can view without blacklight, were created by a joint project between Taiwan’s Academia Sinica, National Taiwan Ocean University and Jy Lin, a private biotechnology company, according to the organizer. The 2012 Taiwan International Aquarium Expo will be held at Taipei World Trade Center Nangang Exhibition Hall from November 9 to 12. (Pichi Chuang/Reuters)

Pesci transgenici fluorescenti prodotti per il mercato nel 2015: (A) Gymnocorymbus ternetzi. (B) Archocentrus nigrofasciatus. (C) Amatitlania nigrofasciata. (D) Pterophyllum scalare. (E) Puntius tetrazona. (F) Oryzias dancena. (G) Danio rerio. (H) Oryzias latipes. (I) Tanichthys albonubes (Fuente: Azoo 2015, Glofish 2015).
.

Betta fish transgenici (omg), vendita negli Stati Uniti
Conclusioni
La modifica genetica del fenotipo degli animali è ormai la nuova frontiera per offrire l’animale dalla colorazione, forma e disegno richiesta dal mercato. In molti possono essere contrari ma la forte diffusione nel mercato spingerà su una politica estremamente commerciale dove ci sarà poco da discutere sulla genuinità di questa pratica portando eventualmente l’acquirente a considerare l’animale non tanto un essere vivo ma solamente un soprammobile o qualcosa da mantenere come i fiori recisi.
L’intero articolo è stato scritto per AqaZero.it; foto dei legittimi proprietari; è vietata la riproduzione senza citare la fonte.